I. HISTÓRICO E DESENVOLVIMENTO
As tríades de Döbereiner
No inicio do século XIX valores aproximados para a massa dos átomos de alguns elementos denominada (massa atômica) havia sido estabelecidos.
 Em 1829, o químico alemão Johann Döbereiner, analisando três elementos quimicamente semelhantes – o cálcio (Ca), o estrôncio (Sr) e o bário (BA) -, percebeu uma relação simples entre suas massas atômicas: a massa do átomo de estrôncio apresenta um valor bastante próximo da média das massas atômica do cálcio e do bário.
Em 1829, o químico alemão Johann Döbereiner, analisando três elementos quimicamente semelhantes – o cálcio (Ca), o estrôncio (Sr) e o bário (BA) -, percebeu uma relação simples entre suas massas atômicas: a massa do átomo de estrôncio apresenta um valor bastante próximo da média das massas atômica do cálcio e do bário. Ele percebeu o mesmo efeito para outras tríades (trios) de elementos químicos, por exemplo, cloro/bromo/iodo e enxofre/selênio/telúrio.
Os químicos da época não se importaram muito com as observações de Döbereiner e estas passaram despercebidas. Seu mérito foi ter sido, aparentemente, o primeiro a mostrar relações entre elementos conhecidos.
O parafuso telúrico de Chancourtois
 Em 1862, o geólogo francês Alexandre Chancourtois (1819-1886) dispôs os elementos químicos conhecidos em ordem crescente de suas massas atômicas numa linha espiral em volta de um cilindro. Tal disposição ficou conhecida como parafuso telúrico de Chancourtois.
Em 1862, o geólogo francês Alexandre Chancourtois (1819-1886) dispôs os elementos químicos conhecidos em ordem crescente de suas massas atômicas numa linha espiral em volta de um cilindro. Tal disposição ficou conhecida como parafuso telúrico de Chancourtois. Ao redor do cilindro foram feitas dezesseis divisões, e os elementos com propriedade semelhantes apareciam uns sobre os outros em voltas consecutivas da espiral. Chancourtois estava sugerindo que as propriedades dos elementos estavam relacionadas ao número que o elemento ocupava na seqüência. As regularidades que ele encontrou não funcionavam para todos os elementos conhecidos e a idéia não recebeu muita atenção.
As oitavas de Newlands
Em 1864, o inglês John Newlands, organizou os elementos em ordem crescente de suas massas atômicas em linhas horizontais, contendo sete elementos cada. O oitavo elemento apresentava propriedades semelhantes ao primeiro e assim por diante, numa relação periódica que lembra a periodicidade das notas musicais.
 A essa repetição de propriedades dentro da seqüência o químico inglês deu o nome de Lei das oitavas. Por buscar essa relação entre a Química e Música, Newlands sofreu o desprezo e o escárnio dos membros da sociedade de Química de Londres. Ao apresentá-lo aos membros dessa entidade, um deles teria perguntado sarcasticamente se ele já teria tentador organizar os elementos na ordem alfabética das letras iniciais dos nomes.
A essa repetição de propriedades dentro da seqüência o químico inglês deu o nome de Lei das oitavas. Por buscar essa relação entre a Química e Música, Newlands sofreu o desprezo e o escárnio dos membros da sociedade de Química de Londres. Ao apresentá-lo aos membros dessa entidade, um deles teria perguntado sarcasticamente se ele já teria tentador organizar os elementos na ordem alfabética das letras iniciais dos nomes. Entretanto seu trabalho foi reconhecido cerca de duas décadas mais tarde, por ser um precursor das idéias de Mendeleev. O grande mérito de Newlands foi a idéia da periodicidade dos elementos em função das massas atômicas.
Mendeleev: periodicidades e previsões
Dmitri Mendeleev foi professor universitário na Rússia e fez uma importante descoberta na história da ciência enquanto estava escrevendo um livro de Química. Ele registrou as propriedades de cada um dos elementos químicos conhecidos (na época e 63) em fixas de papel, cada fixa para um elemento. Manipulando as fichas, na tentativa de entender as idéias antes de escrever determinadas partes da obra, Mendeleev percebeu algo extraordinário.
Na época havia evidências científicas de que os átomos de cada elemento têm massas diferentes. Mendeleev organizou as fichas de acordo com a ordem crescente da massa dos átomos de cada elemento. Notou que nessa seqüência apareciam, a intervalos regulares, elementos com propriedades semelhantes, de modo similar aos que Newlands fizera.
 Havia uma periodicidade, ou seja, uma repetição nas propriedades dos elementos. Foi assim que Mendeleev em 1869 pôde organizar os elementos em uma tabela, na qual aqueles com propriedades semelhantes apareciam numa mesma coluna. Elaborando melhor sua descoberta, ele percebeu que pareciam estar faltando alguns elementos para que ela fosse completada. Mendeleev resolveu deixar alguns locais em branco nessa tabela, julgando que algum dia alguém descobriria novos elementos químicos que pudessem ser encaixados nesses locais, com base em suas propriedades. Ele chegou, até, a prever algumas das propriedades que esses elementos teriam.
Havia uma periodicidade, ou seja, uma repetição nas propriedades dos elementos. Foi assim que Mendeleev em 1869 pôde organizar os elementos em uma tabela, na qual aqueles com propriedades semelhantes apareciam numa mesma coluna. Elaborando melhor sua descoberta, ele percebeu que pareciam estar faltando alguns elementos para que ela fosse completada. Mendeleev resolveu deixar alguns locais em branco nessa tabela, julgando que algum dia alguém descobriria novos elementos químicos que pudessem ser encaixados nesses locais, com base em suas propriedades. Ele chegou, até, a prever algumas das propriedades que esses elementos teriam. Abaixo do silício, por exemplo, Mendeleev suspeitou que deveria existir um elemento que ele denominaria eka-silício e cujas propriedades previu (eka é uma palavra do sâncristo que pode ser traduzida como “ o primeiro a seguir”). Esse elemento foi descoberto em 1886 pelo o alemão Clemens Winkler, que o chamou de germânio. As propriedades do germânio são espantosamente próximas das previstas por Mendeleev.
Além do germânio, outros elementos cuja existência foi prevista por Mendeleev foram descobertos posteriormente, como o escândio (SC), o gálio (Ga) e o polônio (Po). E as propriedades desses elementos são iguais as previstas por ele ou bastante próximas delas.
Moseley e o número atômico
Mendeleev ordenou os elementos de acordo com a sequência crescente de suas massas atômicas. Percebeu, contudo, que algumas penas inversões eram necessárias para que os elementos ficassem corretamente posicionados juntamente a outro com propriedades semelhantes.
 Em 1913, o inglês Henry Moseley fez importantes descobertas trabalhando dom raios X. Ele descobriu uma característica numérica dos átomos de cada elemento que ficou conhecida como número atômico e que posteriormente foi associado ao número de prótons.
Em 1913, o inglês Henry Moseley fez importantes descobertas trabalhando dom raios X. Ele descobriu uma característica numérica dos átomos de cada elemento que ficou conhecida como número atômico e que posteriormente foi associado ao número de prótons. De modo geral, à medida que o número atômico cresce a massa atômica também cresce.
Outros cientistas aprimoraram as descobertas se Mendeleev e de Moseley. Esses aprimoramentos conduziam à atual tabela periódica dos elementos.
Apesar de nela aparecerem muitos elementos que não eram conhecidos na época de Mendeleev, a idéia envolvida é essencialmente aquela proposta por ele, com a ressalva de estarem em ordem crescente de número atômico e não de massa atômica.





 FIGURA (D)
FIGURA (D)

 Figura (E)
Figura (E)
Bibliografia:
1. Química na abordagem do cotidiano(ensino médio) I. Canto, Eduardo Leite do,1966- 3 ed. -São Paulo: Moderna, 2003.
II. A LEI PERIÓDICA
A lei periódica estabelece que quando os elementos são listados, seqüencialmente, em ordem crescente do número atômico, é observada uma repetição periódica em sua propriedade.
III. A TABELA PERIÓDICA MODERNA
A repetição verificada na Lei periódica é a base da estrutura da tabela periódica moderna, na qual as famílias de elementos com propriedade químicas semelhantes são distribuídas em colunas verticais chamadas grupos e como os átomos possuem sete níveis de energia, a tabela é organizada em sete períodos (filas horizontais) relacionados com o número de camadas. Observe a imagem 3.1.

Imagem 3.1
IV. CLASSIFICAÇÃO DOS ELEMENOS NA TABELA
A) QUANTO A DISTRIBUIÇÃO ELETRONICA
Ao comparamos distribuição eletrônica com a tabela periódica, vemos que cada período tem início com um átomo de configuração ns . Estes átomos são de hidrogênio e do grupo 1. Os átomos imediatamente seguintes a estes têm configuração ns ;inclui o hélio e os demais elementos do grupo 2. Pode-se dizer que cada período é iniciado pela adição de um elétron a um novo nível.
O primeiro período consiste em somente dois elementos porque o nível K tem apenas um orbital. O segundo período e o subsequente completam-se com o subnível p do nível mais externo (a subnível np), que pode comporta seis elétrons. Neste caso, ao longo do segundo e terceiro períodos as camadas de Valência dos átomos pode conter de um a oito elétrons, como as configurações de ns e ns para o grupo 1 e 2 a ns np e ns np para o grupo 3 a 0.
No quarto período, uma progressão regular de configurações eletrônicas iniciando com ns e terminando com ns np é interrompida pelo atraso de complementação de um terceiro nível, pois os elétrons são adicionados previamente no subnível 3d . Um preenchimento simular do subnível (n – 1)d ocorre no quinto, sexto e sétimo período. Desse modo, os elementos de transição (grupo B) têm vários números de elétrons no seu subnível (n – 1)d. O subnível d pode conter 10 elétrons; este preenchimento explica o fato de que há dez elementos na série dos elementos de transição.
Ao longo da série de lantanóides e actinóides, o subnível a ser preenchido e o (n – 2)f que é o subnível do terceiro nível externo.
B) QUANTO AS PROPRIEDADES FÍSICO-QUIMICAS;
METAIS - A maioria dos elementos químicos são metais e estão posicionados à esquerda da tabela periódica. Os metais são geralmente bons condutores de calor e de eletricidade, são maleáveis (podendo ser enrolados ou laminados) e dúcteis (podendo ser estirados em finos arames), e tem uma alta refletividade e um brilho característico chamado brilho metálico. Os elementos com estes conjuntos de propriedades estão posicionadas à esquerda na tabela periódica, ainda que, neste caso, “esquerda” signifique mais da metade da tabela, porque o número de metais é maior do que o de não-metais. Todos os elementos de transição e de transição interna são metais e constituem cerca de metade dos elementos representativos.
NÃO-METAIS – Por causa do decréscimo do comportamento metálico, da esquerda pra direita e da base para o topo na tabela periódica, os elementos não-metálicos estão localizados na poção superior da tabela periódica. Os não-metais não apresentam as propriedades dos metais: são pobres condutores térmicos, no estado solido são quebradiços, e não exibem alta refletividade ou brilho metálico. São encontrados à direita, mais especificamente na parte superior à direita da tabela periódica. Percorrendo a tabela da esquerda para a direita em qualquer período, há um decréscimo gradual nas propriedades metálicas. Em um grupo ocorre um aumento nas propriedades metálicas, do topo para a base. A separação entre os metais e os não-metais poderia ser uma linha diagonal da região superior esquerda para a região da base à direita.
OS GASES NOBRES – eles fazem parte do grupo 18 e estão situados na porção direita da tabela periódica. Seus átomos não-combinados são muitos estáveis indicando a periodicidade na tabela.
HIDROGÊNIO – O hidrogênio é um não-metal único. Ele é frequentemente colocado no topo dos grupos 1 e 17 na tabela periódica, mas o hidrogênio não é um metal e tão pouco um halogênio, isso é devido apenas sua configuração eletrônica.
V. ESTRUTURA DA TABELA PERÓDICA
A) GRUPOS:
Na forma reduzida da tabela periódica há dezoito colunas, seqüenciais verticais de elementos. Por determinação da União Internacional da Química Pura e Aplicada (Iupac) os grupos são enumerados atualmente de 1 a 18, mas ainda é bastante comum a utilização de uma representação com letras e números.
A disposição dos elementos na tabela periódica é tal que elementos com propriedades semelhantes ficam num mesmo grupo. Alguns dos grupos, por sua importância para a Química, recebem nomes especiais:
· O grupo 1 grupo dos metais alcalinos;
· O grupo 2 é o grupo dos metais alcalino-terrosos;
· O grupo 13 é o grupo do boro;
· O grupo 14 é o grupo do carbono;
· O grupo 15 é o grupo do nitrogênio;
· O grupo 16 é o grupo dos calcogênios;
· O grupo 17 é o grupo dos halogênios;
· O grupo 18 é o grupo dos gases nobres;
C) PERÍODOS
As filas horizontais da tabela periódica são chamadas períodos e são enumeradas com algarismos arábicos de 1 a 7. Observe que os períodos variam grandemente em comprimento: O primeiro período consiste em somente dois elementos, o sexto período consiste em 32 elementos, em parte porque estão incluídos os lantanoies e o sétimo período que também consiste em 32 elementos, pois então incluídos os 14 elementos actinóides.
D) BLOCOS DE SUBNIVEIS
Você pode perceber que a configuração eletrônica dos elementos do grupo s1, a dos elementos do grupo 2 terminam em s2 e o hélio também termina em s2 . Na continuação dos elementos representativos os elementos dos grupos 13, 14, 15, 16, 17 e 18 terminam no subnível p. Para os elementos de transição externa, todos eles terminam no subnível d, da mesma forma os elementos de transição interna terminam com o subnível f.
Observe a imagem V.1

VI. PROPRIEDADES DOS ELEMENTOS NA TABELA PERIÓDICA
A) RAIO ATÔMICO
Apesar das dificuldades de determinar o raio atômico é possível reunir um conjunto de dados de raios atômicos aproximados obtidos de medidas de distâncias interatômica. Os resultados são mostrados graficamente no gráfico V.1, demonstrando claramente a variação periódica dos raios atômicos em função do número atômico.
OBSERVAÇÕES:
DECRÉSSIMO DO RAIO ATOMICO AO LONGO DO PERÍODO:
De acordo com as configurações eletrônicas, no estado fundamental de Aufbau, ao longo do segundo e do terceiro períodos, os eletros são adicionados na camada de valência. Simultaneamente, é importante relembrar que prótons são adicionados ao núcleo, aumentando a carga nuclear. Este aumento atrai todos os eletros, aproximando-os do núcleo; como resultado, o raio atômico diminui.
MODERAÇÃO NO DECRÉSSIMO DO RAIO ATÔMICO AO LONGO DO PERIODO PELA INTERVENÇÃO DA SÉRIE DOS ELEMENTOS DE TRANSIÇÃO.
A estruturação de configurações eletrônica da série dos elementos de transição é caracterizada por um aumento gradual do número de elétrons na segunda camada externa (n - 1), e não na camada de valência, n. Uma vez que os elétrons são colocados em (n – 1)d, entre o núcleo e camada de valência, eles protegem parcialmente os elétrons da camada de valência da forca de atração exercida pelo núcleo. Este efeito protetor reduz a carga nuclear efetiva mantendo os elétrons de valência no átomo.
No final da série dos elementos de transição, o subnível (n – 1)d se próxima de sua capacidade máxima de 10 elétrons, aumentando o efeito de blindagem; conseqüentemente, as repulsões inter-eletrônicas entre o nível (n – 1) e o nível de valência acarretam um menor aumento no tamanho. Somente após o preenchimento completo do subnível (n – 1)d, no término da série dos elementos de transição, os elétrons serão novamente adicionados no nível mais externo do átomo. A partir daí, o aumento na carga nuclear reassume uma pronúncia contração para o resto do período.
Os lantanóides mostram ainda um maior efeito de blindagem pelos elétrons internos. Percorrendo esta série os elétrons são adicionados ao subnível (n - 2)f, enquanto aumenta, simultaneamente, a carga nuclear. O aumento do efeito blindagem dos elétrons da subnível f compensa quase completamente o aumento da carga nuclear resultando numa pequena contração através da série.
OS RAIOS ATÔMICOS AUMENTAM EM UM MESMO GRUPO
Em cada um dos grupos representativos (A), o aumento e bastante pronunciado para os metais alcalinos (grupo 1A). Este efeito pode parecer surpreendente, pois a carga nuclear é crescente no grupo e, assim, tende a atrair os elétrons mais fortes mente. Entretanto, o número total de elétrons nos níveis aumenta, causando um aumento na distância entre o nível mais externo e o núcleo. Conseqüentemente, percorrendo um grupo, o aumento do número de níveis internos de elétrons implica no aumento do efeito blindagem que compensa o aumento na carga nuclear, resultando num aumento do raio atômico.
RESUMO: Num período, o raio atômico
Aumenta de cima para baixo e da direita para a esquerda.

FIGURA (A)
PARA OS GRUPOS DE TRANSIÇÃO (B), A VARIAÇÃO NO TAMANHO DO ÁTOMO É MENOS PRONUMCIADA DO QUE A VERIFICADA PARA OS ELEMENTOS REPRESENTATIVOS (A).
Analisando qual quer elemento de transição do quarto período e um outro imediatamente abaixo, do quinto período, notamos um apreciável aumento no raio atômico.
INAUTERAÇÃO DO RAIO ATÔMICO NO GRUPO 6
A resposta é encontrada na Contração lantanóidica, anteriormente mencionada. Conforme o procedimento de Aufbau para os 14 lantanoides, o preenchimento do subnível 4f ocorre de modo que o raio do itérbio (Z=70), o último da serie, seja 0,0013 nm menor que o do lantânio (Z=57), o primeiro. A blindagem da camada interna compensa completamente o efeito na carga nuclear. Uma conseqüência desta compensação é que os elementos de transição seguinte ao itérbio têm átomos pequenos, contrariamente ao esperado. A contração lantânóidica é quase compensada pelo fato de que no sexto período os átomos têm uma camada a mais de elétrons do que no quinto, e assim os átomos correspondentes aos elementos de transição nestes dois períodos são semelhantes em dimensões atômicas.
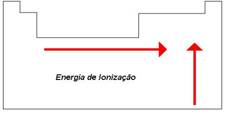
B) ENERGIA DE IONIZAÇÃO
É a mínima energia necessária para remove um elétron de um átomo isolado, no seu estado fundamental. (Uma vez que um átomo isolado está livre da influência de átomos vizinhos, o termo implica um átomo no estado gasoso).
ENERGIA DE IONIZAÇÃO TENDE A AUMENTAR ATRAVÉS DE UM PERÍODO
O gráfico V.2 mostra esta variação para os primeiros seis períodos. Em geral, a carga nuclear aumenta através do período e os elétrons do nível mais externo são atraídos mais fortemente para o núcleo. Conseqüentemente, mais energia é necessária para remover um elétron do átomo.
GRÁFICO V.2
OBSERVAÇÃO:
IRREGULARIDADE NO 2º E 3º PERÍODOS
A figura V.2 mostra que a primeira energia de ionização do boro (z = 5) é menor que a do berílio (Z = 4). O mesmo vale para o oxigênio (Z = 8) comparado ao nitrogênio (Z = 7). Estas irregularidades podem ser explicadas da seguinte maneira: no boro o elétron a ser removido está no orbital 2p, enquanto o berílio está no orbital 2s. Um elétron 2s está mais firmemente preso ao núcleo do que um elétron 2p, o que conduz à baixa energia de ionização do boro. Portanto, menor energia é requerida para mover o elétron 2p do boro, do que o elétron 2s do berílio, mesmo com a maior carga nuclear do boro.
O caso do oxigênio é diferente. A primeira energia de ionização é mais baixa do que a esperada, porque o elétron é removido de um orbital 2p que contem um segundo elétron. Dois eletros no mesmo orbital ocupam a mesma região do espaço e se repelem com maior intensidade do que se estivesse em orbitais diferentes. A repulsão inter-eletronica facilita a remoção do elétron do átomo de oxigênio. No átomo de nitrogênio não há tal repulsão.
AUMENTO NA ENERGIA DE IONIZAÇÃO EM CADA SÉRIO DOS
Isso é causado pelo efeito de blindagem da camada interna de elétrons, praticamente compensada pelo aumento na carga nuclear.
AUTA ENERGIA DE IONIZAÇÃO DOS GASES NOBRES
Para todos eles, exceto o hélio, a remoção de um elétron quebra o octeto de elétrons no nível de valência. A alta energia de ionização é uma das razões de sua pequena tendência a sofrerem reações.
A ENERGIA DE IONIZAÇÃO É DECRESCENTE EM UM GRUPO
O aumento da carga nuclear em um grupo é amplamente compensado pelo efeito de blindagem, relativo ao aumento do número de níveis internos. A principal causa do crescimento da energia de ionização é o aumento do raio atômico, o que diminui a atração do átomo pelos elétrons do nível mais externo. Observe a figura (B).
FIGURA (B)
C) ELETRONEGATIVIDADE
Denomina-se eletronegatividade a tendência que o átomo de um determinado elemento apresenta para atrair elétrons, num contexto em que se acha ligado a outro(s) átomo(s). Embora essa tração se dê sobre todo o ambiente eletrônico que circunda o núcleo do átomo, é de particular interesse a atração que ele exerce sobre os eletros envolvidos nas ligações químicas.
A eletronegatividade é uma propriedade periódica, ou seja, é uma propriedade cujo valor varia regular e periodicamente a mediada que aumenta o número atômico dos elementos. Não é costume atribuir valores de eletronegatividade para os gases, nobres já que eles não apresentam tendências a receber ou compartilhar elétrons.
O gráfico V.3 ilustra que a eletronegatividade é uma propriedade periódica. Para elaborá-lo, a eletronegatividade dos gases nobres foi considerada como zero. Na figura ©, as retas mostram o sentido crescente da eletronegatividade da tabela periódica.


GRAFICO V.3 FIGURA ©
D) ELETROPOSITIVIDADE
A eletropositividade, também denominada de caráter metálico, é uma propriedade periódica que relaciona a tendência de um átomo de perder elétrons. O põe-se á eletronegatividade
Os valores da eletropositividade são determinados quando os átomos estão combinados. Por isso, para os gases nobres, que em condições normais são inertes, não apresentam valores de eletronegatividade.
A eletropositividade de um átomo está intimamente relacionada com o seu raio atômico. Assim:
Quanto menor o raio atômico, maior a atração que o núcleo do átomo exerce sobre o eletro que vai adquirir, por tanto menor a sua eletropositividade. Como conseqüência, esta propriedade tender a crescer na tabela periódica:
Nos períodos: a eletropositividade cresce da direita para a esquerda.
Nas famílias: a eletropositividade cresce de cima para baixo.
Concluindo-se que o elemento mais eletropositivo da tabela é o frâncio. Observe a figura (D).
 FIGURA (D)
FIGURA (D) E) DENSIDADE
As propriedades físicas dos elementos também demonstraram a lei periódica. A figura (E) mostra densidade dos elementos a 25º C, em função do número atômico. A periodicidade na densidade é ilustrada pela sucessão de máximos e mínimos em um gráfico, embora estas variações não sejam muito regulares, pois diferentes características estruturais influenciam na densidade da substância.

NUM GRUPO: a densidade de um elemento aumenta com o número atômico, o que ocorre de cima para baixo.
NUM PERÍODO: a densidade cresce da extremidade para o centro. Observe a
Figura (E).
 Figura (E)
Figura (E)VII. CONCLUSÃO
Como foi explanado, a lei periódica estabelece que as propriedades dos elementos são funções periódica de seus números atômicos.um arranjo baseado nessa lei agrupa, na tabela periódica, famílias de elementos com propriedade semelhantes em colunas verticais chamadas grupos. Por conveniência e muita lógica também foram criados filas horizontais, que na tabela periódica são chamados de períodos enumerados de 1 a 7.
Ao analisarmos, a organização da tabela periódica, observamos que ela esta esquematizada levando em consideração a configuração eletrônica, resultante da hierarquia mecânico-quântica dos orbitais, subníveis e níveis. Por consequência da periodicidade na distribuição eletrônica, é destacado varias propriedades atômicas que ilustra a periodicidade, como por exemplo, o raio atômico (medida do tamanho do átomo em condições especificas), a energia de ionização (energia necessária para a remoção de um elétron de um átomo gasoso) e a eletronegatividade.
As propriedades físicas como a densidade e o ponto de fusão também ilustram a periodicidade, embora esta não seja muito regular devido à complexa relação destas propriedades com a estrutura. Já as propriedades químicas são frequentemente usadas na ilustração do comportamento periódico, pois existe uma transição gradual das propriedades metálicas para as não-metálicas, da esquerda para a direita através de um período, e da base para o topo em um grupo.
Enfim, a tabela está na comas que vemos não é por acaso nem por estética, mais sim obedecendo varias regras sistemática de uma entidade que rege a Química (Iupac).
VIII. BIBLIOGRAFIA
Russel, J.B. Química Geral. Trad. De M. Guekezian. São Paulo-2. Ed. –Makron Books,1994.
Química (ensino médio) I. Canto, Eduardo Leite do, 1966- Moderna.II. Tílulo. Bibliografia:
1. Química na abordagem do cotidiano(ensino médio) I. Canto, Eduardo Leite do,1966- 3 ed. -São Paulo: Moderna, 2003.